par Adeline Gigliano
adjointe technique principal de recherche et de formation
ATRFP1
Introduction
Dans l’enseignement de spécialité de première, lorsqu’on aborde la relation entre génotype et phénotype en prenant l’exemple de la drépanocytose, l’électrophorèse des hémoglobines est un passage obligé dès que l’on veut dépasser le simple récit clinique pour entrer dans le lien génotype-phénotype.
En pratique pourtant, il est rarement possible de manipuler de « vrais » sérums d’individus pour des raisons évidentes de sécurité, de logistique et de réglementation. D’où le succès des électrophorèses de substitution, qui permettent de simuler la séparation de molécules grâce à de simples colorants.
Ces montages ont toutefois un défaut récurrent que les élèves repèrent vite, même sans le formuler en ces termes : le caractère très « artificiel » des résultats. Les mélanges de colorants de couleurs différentes produisent des profils spectaculaires mais peu réalistes par rapport à une véritable électrophorèse d’hémoglobines, où les bandes révélées présentent toutes la même teinte. On se retrouve alors avec un résultat qui certes aide à faire passer l’idée générale de migration différentielle, mais au prix d’une représentation trompeuse du résultat attendu.
Le protocole présenté dans cet article s’inscrit dans cette logique de substitution, tout en cherchant à en limiter les dérives. Il propose d’utiliser un mélange de deux colorants rouges dont les mobilités électrophorétiques diffèrent légèrement, afin de simuler les profils d’électrophorèse d’individus homozygotes HbA//HbA ou HbS//HbS et hétérozygotes HbA//HbS. On conserve ainsi les avantages des colorants alimentaires ou de laboratoire en termes de sécurité et de coût, tout en obtenant des bandes d’une couleur unique, plus proches visuellement d’un profil réel.
Protocole (fiche laboratoire)
Préparation des colorants
Nous utilisons deux colorants rouges ayant des mobilités électrophorétiques différentes : le rouge Ponceau et le colorant alimentaire E124.
Clin d’œil aux pratiques de laboratoire : dans une véritable électrophorèse de protéines, le rouge Ponceau est justement utilisé comme colorant de révélation après la migration, et non comme constituant de l’échantillon.
Le rouge Ponceau doit être dilué (facteur de dilution 10) afin de ne pas être trop intense par rapport au colorant alimentaire. Il est possible que nous devions effectuer quelques ajustements de dilution en fonction de la marque du colorant alimentaire utilisé.
Une fois les deux colorants correctement équilibrés, nous les utilisons purs pour les individus homozygotes, ou mélangés (50 % de chaque) pour simuler le sérum d’un individu hétérozygote.
Préparation du gel
Il s’agit d’un gel de gélose (Agar-agar) préparé à 1%. Il est inutile d’utiliser une solution tampon.
Pour 100 mL :
- peser 0.8g d’agar-agar
- mélanger dans 100 ml d’eau distillée
- porter à ébullition dans un bécher
- laisser refroidir jusqu’à ce qu’il soit possible de saisir le bécher à main nu (environ 60°C)
- verser le gel en respectant les quantités préconisées par le constructeur de la cuve
- placer le peigne dans le gel
Préparation du tampon de migration
Puisqu’il ne s’agit pas de protéines, nous n’utilisons pas de véritable solution tampon, mais simplement une eau minérale.
La difficulté réside dans le fait que, si l’eau est trop minéralisée, l’alimentation de la cuve se met en sécurité (l’intensité du courant étant trop forte), et si elle l’est trop peu, la migration ne se fait pas.
Après avoir testé plusieurs marques, nous avons obtenu des résultats satisfaisants avec de l’eau gazeuse de marque St-Yorre. Il est également possible de produire soi-même une eau salée à partir d’eau distillée et de sel.
Précisons que nous utilisons des cuves distribuées par Sordalab, mais que nous avons également obtenu par le passé des résultats satisfaisants avec des cuves provenant d’autres distributeurs.
Dépôt des « sérums »
Nous conseillons de mettre à disposition les sérums aux élèves dans des tubes Eppendorf rassemblés dans un portoir adéquat.
Les élèves déposeront le contenu de chaque tube dans un puits, en respectant la quantité préconisée.
ATTENTION : le rouge Ponceau peut provoquer des lésions oculaires graves/sévères (irritation), ainsi que sur la peau. Le port des gants et des lunettes est obligatoire.

Résultat obtenu
Après 10 minutes de migration, les bandes sont suffisamment espacées pour que le gel soit exploitable.
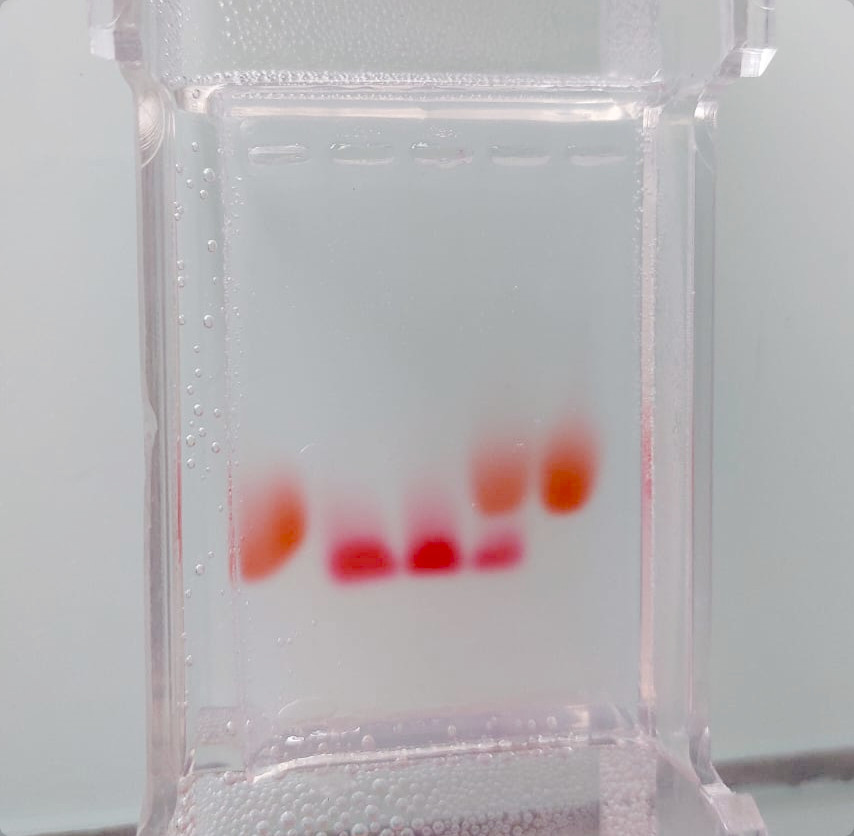
Gel obtenu avec les produits de substitution (colorant alimentaire et rouge Ponceau)
Comme on peut le voir sur la photographie, elles sont nettement séparées et la lecture du gel ne souffre d’aucune ambiguïté.
Nous constatons certes une très légère nuance dans les teintes des deux rouges, mais elle reste si discrète que, jusqu’à présent, aucun élève ne l’a relevée.
A titre de comparaison, voici à quoi ressemble un gel lorsque l’on utilise de véritables solutions d’hémoglobines, et qu’on les révèle avec … du rouge Ponceau.
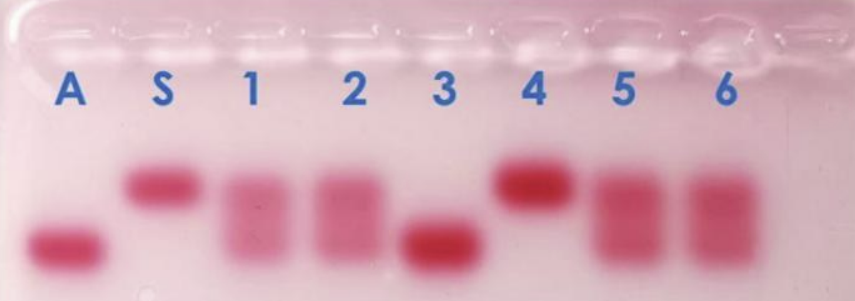
Gel obtenu avec d’authentiques solutions d’hémoglobine, révélées au rouge Ponceau.
(source Sordalab)
Conclusion
Ce protocole d’électrophorèse de substitution ne prétend évidemment pas reproduire fidèlement toutes les contraintes d’une véritable électrophorèse d’hémoglobines (et en cela pourrait ne pas être adapté à un usage dans le cadre des ECE).
Il s’agit d’un modèle simplifié, qui s’affranchit des questions de sécurité biologique, de préparation des échantillons et de réglages fins des tampons. Mais il permet, avec un matériel courant et des produits peu coûteux, d’obtenir des profils de migration suffisamment réalistes pour travailler sérieusement la notion de phénotype moléculaire dans le cadre de la drépanocytose.
L’utilisation de deux colorants rouges aux mobilités différentes présente ici un avantage décisif par rapport aux protocoles plus classiques faisant appel à des mélanges de couleurs variées : les bandes obtenues ressemblent davantage à celles que l’on observerait sur un gel réel, avec une teinte homogène et des différences qui portent sur la position, non sur la couleur. Les élèves sont ainsi amenés à se concentrer sur l’essentiel, c’est-à-dire la comparaison des profils HbA//HbA, HbA//HbS et HbS//HbS, et la mise en relation de ces profils avec les génotypes correspondants (par exemple en utilisant en parallèle le logiciel Geniegen2, et en fournissant aux élèves des arbres généalogiques).
On rappellera toutefois qu’en contexte réel, la visualisation des bandes sur le gel ne se fait qu’après une étape supplémentaire de coloration, au cours de laquelle un colorant est ajouté puis éventuellement décoloré en fond de gel. Dans notre protocole, la couleur est présente dès le départ, ce qui simplifie la mise en œuvre mais introduit un nouvel écart par rapport à la pratique de laboratoire. Libre à chaque enseignante et chaque enseignant de décider s’il est pertinent de signaler explicitement cette différence aux élèves, ou de la réserver à un temps d’échange ultérieur, par exemple pour discuter des limites du modèle utilisé et des compromis inhérents aux simulations.
Ce dispositif reste perfectible : chacune et chacun pourra ajuster la dilution des colorants, la durée de migration ou la nature de l’eau utilisée en fonction de son matériel et de ses contraintes. Mais dans l’état, il offre un compromis simple et robuste entre réalisme visuel, faisabilité en classe et exigence scientifique minimale. C’est précisément dans cet espace, celui d’une simulation assumée comme telle mais contrôlée, que cette électrophorèse « rouge sur rouge » trouve tout son intérêt.

